CLINUVEL Kommuniqué V
Sehr geehrte Aktionärinnen und Aktionäre, liebe Freunde,
Einleitung
Auf dem Weg in den Winter der nördlichen Hemisphäre haben unsere Teams bereits einen Großteil der Weichen für 2022 gestellt und wichtige kommerzielle und klinische Meilensteine erreicht.
Trotz der anhaltenden Einschränkungen der Pandemie und neuer Infektionswellen in weiten Teilen Europas gibt es einen gewissen Optimismus. Wir haben uns mit Impfstoffen an die Realität von COVID-19 angepasst und arbeitenauf eine „neuen Normalität“ hin. Als Teil dessen sehen wir bereits, dass unsere klinischen, kommerziellen und Investorenteams in der Lage sind, mehr von ihrer Arbeit in der physischen statt in der virtuellen Welt zu erledigen – ein Trend, von dem wir alle hoffen, dass er anhält. Krankenhäuser und Gesundheitssysteme haben sich gleichermaßen angepasst, und obwohl dieser Optimismus kein Grund zur Selbstzufriedenheit sein sollte, hoffen wir, im Jahr 2022 ein vorhersehbareres Jahr des klinischen und kommerziellen Betriebs erleben zu koennen.
Verständnis der Behandlung für Patienten mit Erythropoietischer Protoporphyrie (EPP)
Seit 2006 konzentriert sich das CLINUVEL-Team auf die Entwicklung der ersten Behandlung für Patienten mit der seltenen Stoffwechselstörung Erythropoetische Protoporphyrie (EPP). Vielleicht nicht überraschend für diejenigen, die mit seltenen Krankheiten arbeiten, aber von vielen unserer Leser weniger bekannt, ist, dass unser Team ständig neue Facetten über die einzigartige Natur und die Auswirkungen dieser Erkrankung auf Patienten und diejenigen, die sie betreuen, kennen lernt.
Wie viele seltene Krankheiten ist EPP schlecht charakterisiert. Dies bedeutet nicht, dass die Krankheit nicht verstanden wird, sondern dass die Patientenerfahrung insgesamt nicht gut ausgedrueckt oder quantifiziert wurde, obwohl sie erstmals 1961 in der medizinischen Literatur beschrieben wurde. Einfach ausgedrückt ist EPP eine lebenslange, schwere genetische Erkrankung von Häm-Biosynthese, die zu einer absoluten Lichtunverträglichkeit führt, insbesondere im sichtbaren (blau) und nahe sichtbaren (ultraviolett, UV) Spektrum. Die Patientenerfahrung ist jedoch alles andere als einfach.
Die meisten EPP-Patienten berichten über eine Lichtunverträglichkeit – eine, die je nach früherer Exposition, allgemeinem Gesundheitszustand und einer Reihe vermuteter beitragender Faktoren variiert – was bedeutet, dass sie nicht länger als einen kurzen Zeitraum Licht (einschließlich Sonnenlicht) ausgesetzt sind. gemessen in Sekunden oder Minuten. Nach kurzer Lichtexposition treten bei einigen (aber nicht allen) EPP-Patienten ein Prodromalsymptom auf, ein Warnzeichen dafür, dass eine weitere Exposition zu einer schwächenden Hautreaktion, Phototoxizität, führt.
Im Falle einer Überexposition (wiederum innerhalb von Minuten) erleben EPP-Patienten das volle Ausmaß einer phototoxischen Reaktion, ein tiefes Brennen, da die Kapillaren in den tieferen Hautschichten beschädigt oder zerstört werden. Dies wird sich mit der Zeit mit sichtbaren Symptomen manifestieren, die oft zunächst nur als leichte Schwellung oder Erythem auftreten, obwohl der Patient mit einem Gefühl, das mit neuropathischen Schmerzen vergleichbar ist, handlungsunfähig ist. Später treten tiefere Wunden und Narben auf. Weitere Reize wie Hitzeschwankungen, Druck und weitere Lichteinwirkung verschlimmern die Reaktion und die Patienten können die Nacht oft nicht durchschlafen. Analgetika – jeglicher Art, einschließlich Morphium – haben keinen Einfluss auf die Reaktion. Eltern können Kinder mit EPP nicht mit Körperkontakt trösten, da dies die Reaktion verschlimmert. Erwachsene Patienten, die sich ihres Leidens bewusst sind, auch wenn sie nicht diagnostiziert werden, werden ihr Leben grundlegend ändern, um eine Exposition zu vermeiden.
EPP hat einen deutlichen Einfluss auf die psychische Gesundheit der Patienten. Wenn Patienten die Folgen einer Überexposition verstehen, werden sie gegenueber des Lichts in jeder Umgebung hypersensibel, weil sie befürchten, dass sie eine phototoxische Reaktion möglicherweise nicht vermeiden können. Parallel dazu berichten viele von einem „sechsten Sinn“, einer undefinierten Beziehung zu ihrem Zustand, sodass sie sich der Expositionsmenge, die notwendig ist, um eine Reaktion auszulösen, akut bewusst sind. (Diese Intuition wird oft mit dem „Priming“-Phänomen bei EPP in Verbindung gebracht, bei dem eine kumulative kurze Lichtexposition über mehrere Tage ausreicht, um eine phototoxische Reaktion auszulösen). Ein Patient fasste mir diese Erfahrung einmal so zusammen, dass er in seinem Leben ein konstant niedriges „Brummen“ hatte, ähnlich einem Störrauschen auf einer Hochfrequenz: eine unnachgiebige Erinnerung daran, dass eine phototoxische Reaktion möglicherweise nur wenige Augenblicke entfernt ist. Der Patient, der ebenfalls medizinisch qualifiziert war, bemerkte weiter, dass das Summen eine unermüdliche Ablenkung war, eine ständige Krankheitslast, die es unmöglich machte, sich voll zu konzentrieren.
Die Behandlung mit Afamelanotid hatte bei diesem Patienten das Brummen beseitigt. Es ermöglichte nicht nur eine Freiheit von Phototoxizität, sondern vor allem von Angst und Angst, die mit einem ständigen Bewusstsein der Lichtexposition einhergingen. Es sorgte für ein neues und begehrtes „Normal“.
Anekdoten wie diese geben unserem Team nicht nur eine starke Motivation, unsere Arbeit fortzusetzen, sondern sie wecken auch die Neugier, die Krankheiten, die wir bekämpfen wollen, besser zu verstehen. Während unseres gesamten EPP-Programms haben wir daran gearbeitet, Daten zu sammeln, um die Krankheit zu verstehen und die Ergebnisse für die Patienten zu verbessern. In Europa konzentrierte sich diese Arbeit in den letzten fünf Jahren auf die Einrichtung des Europäischen EPPKrankheitsregisters (EEDR), das größte Register seiner Art für EPP und wahrscheinlich die beste Forschungsressource, die es jemals für die Krankheit gab.
Jedes Jahr erfassen wir Tausende von pseudonymisierten Datenpunkten der europäischen EPP-Gemeinschaft, um ihre Gesundheit und ihr Wohlbefinden sowie die langfristigen Auswirkungen der Behandlung zu verfolgen. Das Register konzentriert sich zwar hauptsächlich auf die Sicherheit (der EEDR ist Teil der laufenden europäischen Sicherheitsstudien nach der Zulassung von SCENESSE®), erfasst aber auch Wirksamkeitsergebnisse, Daten, die den anhaltenden therapeutischen Nutzen der Behandlung belegen. Zusammengenommen geben uns diese realen Beweise (und die Behörden) die Sicherheit des Sicherheitsprofils von SCENESSE® in EPP sowie einen kontinuierlichen Hinweis auf den klinischen Nutzen.
Jedes Jahr führt das Team von Dr. Bilbao Analysen von Daten aus dem EEDR durch, um den Behörden zu berichten, eine Aufgabe, die derzeit für 2021 läuft. Der neueste Bericht, der Daten bis zu einem „Lock“-Punkt vom 22. Juni 2020 sammelt, vermittelt dem Team die längerfristigen Auswirkungen der Behandlung; diese werden hier geteilt.
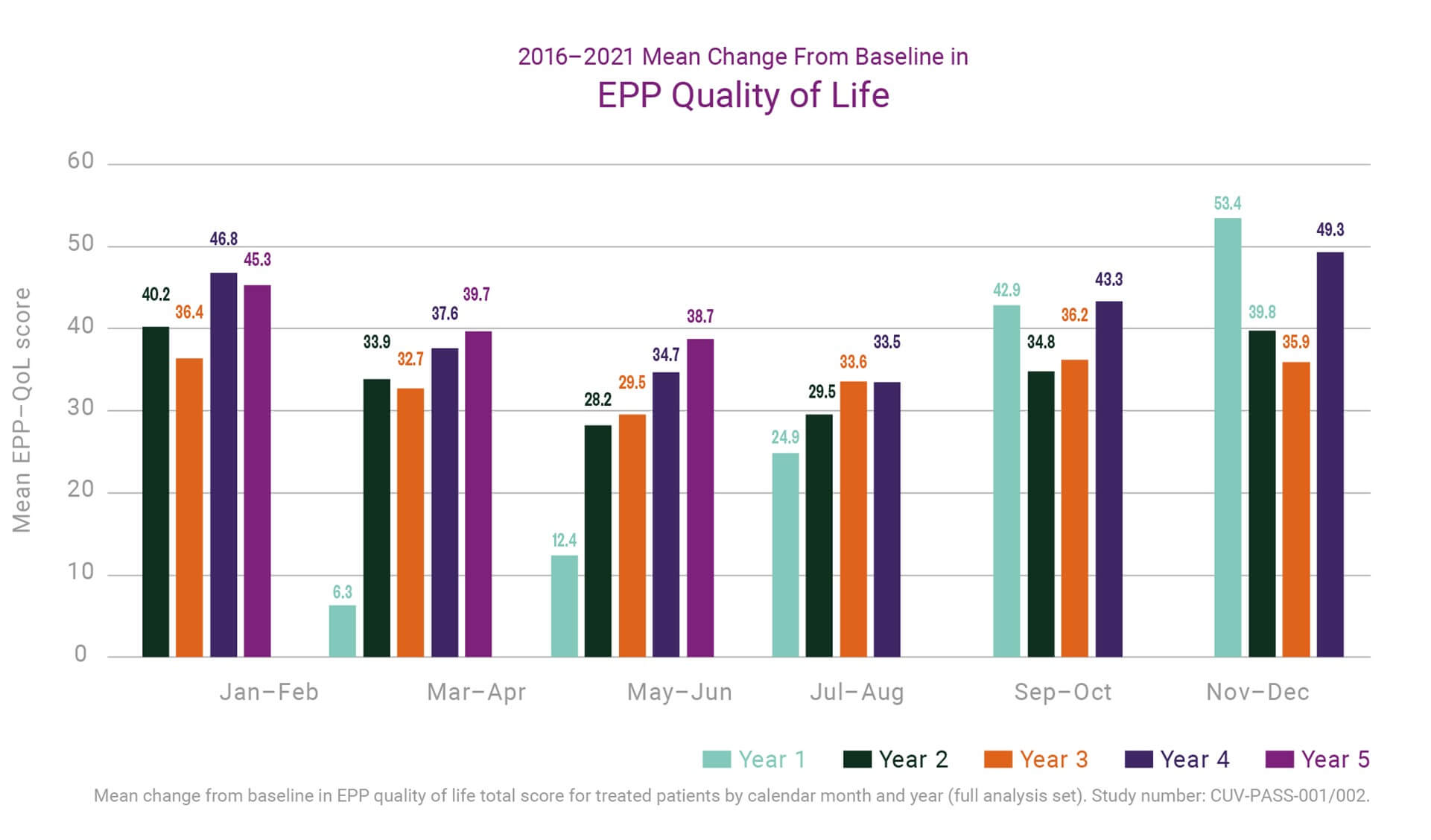
Bis Juni 2020 wurde eine kleine Anzahl von EPP-Patienten, die in den EEDR aufgenommen wurden, über mehr als zehn Jahre in klinischen Studien, Compassionate- und Special-Access-Programmen unter der EU-Zulassung, behandelt. Viele Weitere hatten fünf oder mehr Jahre Behandlung erhalten und die meisten mindestens zwei Jahre. Bei diesen Patienten blieb nicht nur das Sicherheitsprofil des Produkts erhalten, sondern es zeichneten sich auch Trends bezüglich der kumulativen Wirkung der Behandlung ab. Über fünf Jahre hinweg haben wir eine konstante Verbesserung der Lebensqualität der Patienten (QoL; gemessen mit dem krankheitsspezifischen EPP-QoL-Tool) im Vergleich zum Ausgangswert festgestellt. Interessanter ist, dass die durchschnittliche Verbesserung in den Sommermonaten (wenn Patienten das größte Risiko für Phototoxizität aufgrund einer erhöhten Umweltbelastung haben) vom ersten bis zum fünften Behandlungsjahr Jahr für Jahr zugenommen hat (siehe nachstehende Grafik). Dies deutet auf einen noch größeren Nutzen einer Langzeitbehandlung hin.
Es ermöglichte nicht nur eine Freiheit von Phototoxizität, sondern vor allem von Angst und Angst, die mit einem ständigen Bewusstsein der Lichtexposition einhergingen. Es sorgte für ein neues und begehrtes „Normal“.
Parallel dazu deuteten die Daten bis Juni 2020 darauf hin, dass die Patienten bei klinischen Besuchen im Frühjahr im 2. bis 5. Behandlungsjahr im Vergleich zu ihrem ersten Jahr weniger Phototoxizitätsepisoden hatten und dass die Reaktionen insgesamt weniger schwerwiegend waren. Schließlich zeigen zusammengesetzte Maßnahmen zur Bewertung der Lichtexposition und Phototoxizität, dass die Gesamtlichttoleranz der Patienten mit jedem weiteren Behandlungsjahr erhöht wird.
Die Daten sind zwingend und werden weiter ausgewertet, bevor weitere Ansprüche geltend gemacht werden. Nichtsdestotrotz helfen diese unseren Überlegungen, Diskussionen und Ansätzen zur Weiterentwicklung von Behandlungen für EPP, insbesondere im Hinblick auf eine sichere und wirksame Behandlung für pädiatrische Patienten.
Seit der Veröffentlichung der ersten Phase-II-Studie zu Afamelanotid in EPP (CUV010) im New England Journal of Medicine im Januar 2009 wurden deutliche Fortschritte im Verständnis von EPP, seinen Auswirkungen auf das Leben der Patienten und der Rolle der ersten Lichtschutzmittel Therapie erzielt. Während wir unser Programm vorantreiben, ist das Team von CLINUVEL bestrebt sicherzustellen, dass wir unser Wissen und unsere Erkenntnisse zum Wohle der Patienten weiterhin teilen können.
Angebot und Nachfrage Nach der Zulassung
CLINUVEL ist nicht immun gegen globale Trends und wie bei vielen Unternehmen wurde 2021 die Lieferkette des Unternehmens getestet. Insbesondere der Mangel an Frachtkapazitäten im Luftverkehr (für den Versand unter Kühllagerbedingungen) und Rückstände bei unseren Lieferpartnern haben unser Team dazu veranlasst, einen umfassenden Ansatz zur Sicherstellung der Versorgung zu verfolgen. Unser Fokus liegt immer auf der Garantie, sicherzustellen, dass durch die von uns durchgeführten Maßnahmen keine Personen, in diesem Fall die Patienten, denen wir helfen möchten, gefährdet werden.
Unsere Ansätze wären jedoch ohne regulatorische und klinische Unterstützung nicht möglich. In einem stark regulierten Umfeld sind diejenigen, die die Verwendung eines Produkts beaufsichtigen und die persönliche Verantwortung für die Patientenversorgung tragen, gleichermaßen an der Risikominimierung und Aufrechterhaltung der Sicherheit beteiligt. Die anhaltende Unterstützung sowohl von Aufsichtsbehörden als auch von Mitarbeitern der Expertenzentren (Apotheken- und Klinikteams) spiegelt die anhaltende Notwendigkeit wider, EPP-Patienten zu behandeln und den Wert des Zugangs zu einer Behandlung zu verstehen. Gleichzeitig danken wir unseren europäischen und US-Teams, die für Produktvertrieb, Qualitätssicherung und regulatorische Interaktionen verantwortlich sind, für ihr kontinuierliches Engagement. Ihre langen Nächte, fehlende Feiertage und Ihre allgemeine Entschlossenheit, Patienten zu helfen, sind allgemein anerkannt.
Trotz der Verkürzung des Tageslichts, wenn der Winter auf der Nordhalbkugel näher rückt, scheint die Nachfrage nach EPP-Behandlungen für viele Patienten das ganze Jahr über konstant zu sein. Aus diesem Grund passen wir unsere Lieferkette an und prüfen, wie wir ihre Robustheit längerfristig sicherstellen können, um die nächsten Herausforderungen zu meistern, insbesondere da immer mehr Patienten eine Behandlung in Anspruch nehmen.
CLINUVEL ist nicht immun gegen globale Trends und wie bei vielen Unternehmen wurde 2021 die Lieferkette des Unternehmens getestet.
Erweiterung des Melanocortin-Portfolios von Clinuvel: Neuracthel®
Über zwei Jahrzehnte hat das Team von CLINUVEL beispiellose Expertise in der Anwendung von Melanocortinen, einer speziellen Gruppe bioaktiver Hormone und ihrer Analoga, entwickelt. Diese Peptide (kurzkettige Moleküle, die Aminosäuren umfassen) binden an die fünf Melanocortin-Rezeptoren (MC1R bis MC5R) auf Zellen im ganzen Körper und wirken sich auf die Pigmentierung, Entzündung, Energiehomöostase, Appetit und sexuelle Funktion aus.
CLINUVELs erstes kommerziell zugelassenes Produkt SCENESSE® ist eine injizierbare, subkutane Implantatformulierung mit kontrollierter Freisetzung von Melanocortin Afamelanotid, einem Analogon des natürlich vorkommenden alpha-Melanozyten-stimulierenden Hormons. Es ist gut bekannt, dass Afamelanotid hauptsächlich an MC1R und MC4R bindet und seine Wirkung auf Zellen im ganzen Körper ausübt. Aufgrund dieses Verständnisses – und des Verständnisses einer angemessenen Dosierung durch die Formulierung mit kontrollierter Freisetzung – konnte CLINUVEL das SCENESSE®-Implantat für EPP erfolgreich vermarkten und neuartige flüssige Formulierungen für die klinische Anwendung als PRÉNUMBRA® entwickeln.
Neben Afamelanotid hat CLINUVEL ein Portfolio neuartiger proprietärer Melanocortine entwickelt, die in präklinischen Stadien weiterentwickelt werden. CUV9900 und VLRX001 werden beide auf ihr Potenzial zur Unterstützung bestimmter Zielgruppen untersucht.
Im Rahmen der Entwicklungsarbeit von CLINUVEL mit Melanocortinen hat das Unternehmen eine einzigartige Expertise in der Formulierungsarbeit aufgebaut, wobei das Forschungs-, Entwicklungs- und Innovationszentrum von VALLAURIX Singapur eine Reihe praktikabler Dosierplattformen für Produkte der nächsten Generation entwickelt hat. Diese Plattformen ermöglichen eine kontrollierte Dosierung von Peptidarzneimitteln und nutzen die wichtigsten Erkenntnisse aus der Entwicklung von SCENESSE® und PRÉNUMBRA®.
Im Mittelpunkt des Ansatzes von CLINUVEL stand seit jeher die Anwendung unseres Fachwissens und unserer Technologie für Patienten, denen therapeutische Alternativen fehlen. Dies zeigt sich in unserer erstmaligen Behandlung von EPP-Patienten sowie in unserem klinischen Fokus auf Xeroderma pigmentosum (XP; keine Behandlung), Vitiligo (kein anerkannter Behandlungsstandard) und ischämischer Schlaganfall (die meisten Patienten haben keinen Anspruch auf Standardbehandlung, bzw. Pflege). Es liegt daher in der Verantwortung unseres Konzerns, unser Know-how dort einzusetzen, wo sich Chancen bieten.
Adrenocorticotropes Hormon (ACTH) ist eine solche Gelegenheit, die in den letzten Jahren unsere Aufmerksamkeit auf sich gezogen hat. Wie Anfang November angekündigt, entwickelt CLINUVEL neue Formulierungen von ACTH als NEURACTHEL®, sowohl mit sofortiger als auch mit modifizierter Freisetzung, nachdem die Versorgung des Wirkstoffs nach einem aktuellen Standard der Guten Herstellungspraxis (cGMP) sichergestellt ist. Im Gegensatz zu Afamelanotid – wo CLINUVEL die Umgebung schaffen musste, um ein neuartiges Melanocortin zu akzeptieren und das Sicherheitsprofil zu erstellen – ist ACTH von der medizinischen und regulatorischen Gemeinschaft gut anerkannt. Es besteht bereits eine weltweite Nachfrage nach dem Produkt, die bis 2031 auf 1,91 Milliarden USDollar geschätzt wird, und Unterbrechungen der Versorgung mit bestehenden Formulierungen für Patienten mit einer Reihe von Erkrankungen. Den größten Wert sehen wir jedoch für diejenigen Patienten, die zwar von NEURACTHEL® unterstützt werden, aber von der Medizin vernachlässigt werden; ein echter medizinischer Bedarf. Im Laufe unserer Programme werden wir mehr über die beabsichtigten Wege für NEURACTHEL® berichten.
CLINUVEL entwickelt neue Formulierungen von ACTH als NEURACTHEL®, sowohl mit sofortiger als auch mit modifizierter Freisetzung.
Investor Relations (Mr Malcolm Bull)
Die jüngsten Ereignisse
CLINUVEL hat vor kurzem an mehreren Konferenzen teilgenommen, an denen institutionelle Anleger Interesse an unseren EPP-, DNA-Reparatur- und AIS-Programmen (Schlaganfall) sowie an der Aufnahme unserer rezeptfreien Produktlinien (OTC) gezeigt haben. Wir waren auch in den Medien und durch Webinare aktiv, um die Geschichte von CLINUVEL zu kommunizieren.
Nachfolgend finden Sie eine Zusammenfassung der jüngsten Präsentationen und Interviews des Managements von CLINUVEL:
- CLINUVEL Webinar zu den Jahresergebnissen, 26 August;
- Ausbiz-Interview, 26 August;
- Youtube-Interview mit M. Rohde, 28 August;
- TeamInvest-Webinar, 30 August;
- HC Wainwright Global Healthcare Conference, 13 September;
- Goldman Sachs Healthcare Day, 06 Oktober;
- Operations Update Webcast II, 07 Oktober;
- Morgans Scone, Value in the Vines Investor Conference, 22 Oktober;
- CLINUVEL-Investoren Webinar, 26 Oktober;
- Nasdaq-Interview „TradeTalks”, 26 Oktober;
- Youtube-Interview mit M. Rohde, 7 November;
- Strategisches Update III, 08 November;
- Ansprache des Lehrstuh und Präsentation des Geschäftsführers auf der Jahreshauptversammlung 2021, 10 November; und
- Jefferies London Healthcare Conference, 18 November.
Auf der Value in the Vines-Konferenz fand eine ausführliche und spannende Diskussion zwischen den Morgans Scone-Direktoren Sam Paradice und Shaun Trewin und unserem Geschäftsführer Dr. Philippe Wolgen statt. Wir vertrauen darauf, dass unsere Leser aus der einstündigen Kaminsitzung neue Einblicke in die Gründung und Ausrichtung von CLINUVEL gewinnen konnten.
Wir möchten auch alle Missverständnisse aus dem Titel des Interviews von CLINUVEL mit Nasdaq TradeTalks im Oktober korrigieren, „Seeking Access to Nasdaq to Raise Capital“. Die Behauptung von CLINUVEL war, dass viele Unternehmen in der Anfangsphase eine Finanzierung über eine Nasdaq- Notierung suchen, um ihren Betrieb zu finanzieren, und dass sich die Position von CLINUVEL von der dieser Unternehmen unterscheidet. Die letzten fünf Jahre des kommerziellen Betriebs haben es ermöglicht, ausreichende Barreserven aufzubauen, um den geplanten organischen Wachstum und die Expansion von CLINUVEL selbst zu finanzieren. Während des Interviews wurde argumentiert, dass CLINUVEL „aus einer Position der Stärke“ agiert, und dies unterscheidet uns von vielen Kollegen.
Jahresbericht 2021
Es ist an der Zeit, in diesem Kommuniqué zu berichten, dass wir auf den am 08. Oktober veröffentlichten Jahresbericht 2021 viel positives Feedback erhalten haben. Die Inhalte wurden als informativ befunden, unterstützt durch wirkungsvolles Design und Grafiken. Andere merkten an, dass das Thema „Öffnen der Tür“ für CLINUVELs Wachstum und Expansion den bisherigen Weg des Unternehmens illustriert und den Kontext für seine strategischen Initiativen liefert. Wir sind der Meinung, dass alle Stakeholder zu Recht stolz auf ihre Unterstützung des Unternehmens und seiner Leistungen sein können, wie im Geschäftsbericht 2021 zum Ausdruck kommt. Der digitale Geschäftsbericht 2021 ist auf der Website des Unternehmens verfügbar.
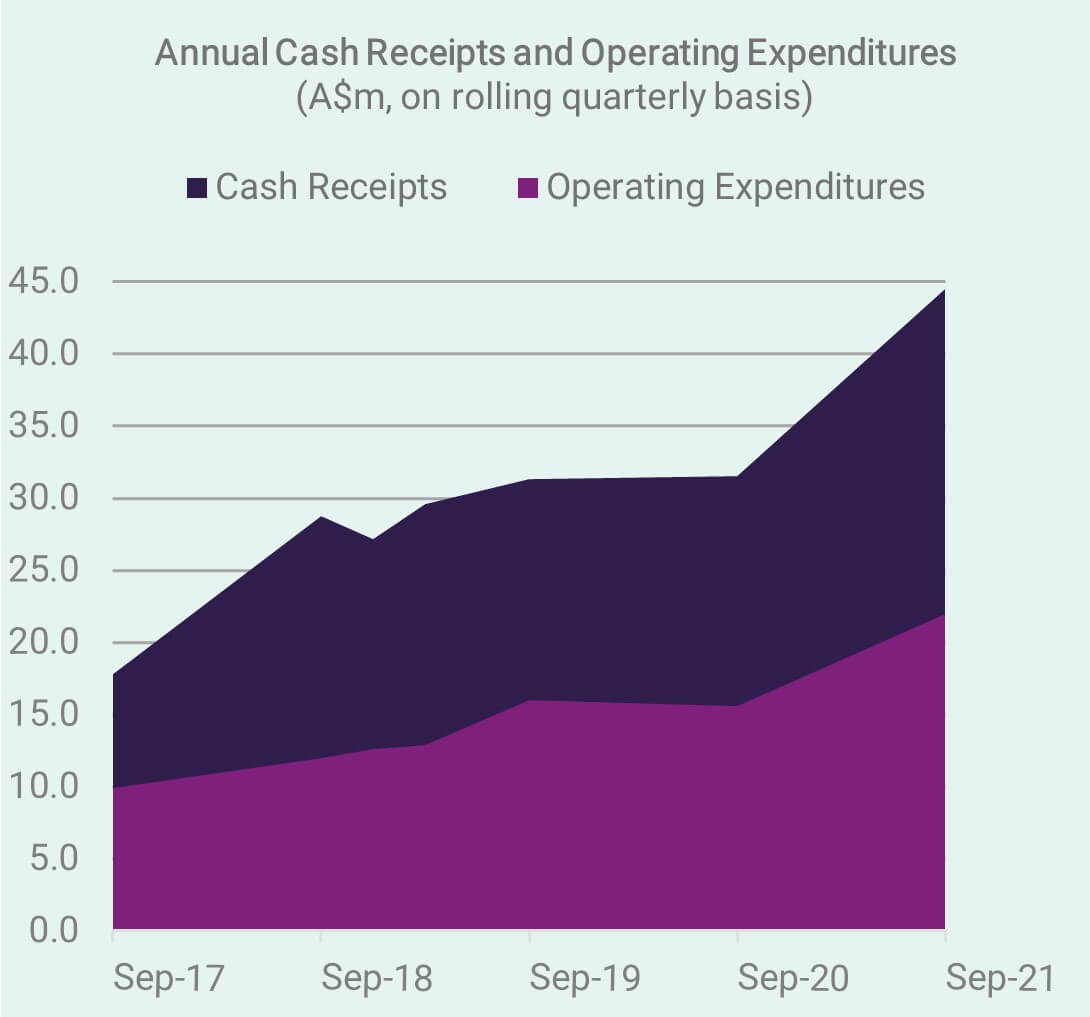
Bareinnahmen – September-Quartal 2021
Wir blicken auf ein weiteres hervorragendes Quartal (Ende 30. September) zurück, in dem der Trend steigender Bareinnahmen weiterhin die Grundlage für Wachstum, Reinvestitionen in das Geschäft und den notwendigen Puffer zur Bewältigung der nächsten zyklischen Korrekturen an den Aktienmärkten bildet . Anlegern wird empfohlen, den neuesten Anhang 4C und den Tätigkeitsbericht zu lesen.
Als profitables Unternehmen, das aus kommerziellen Aktivitäten einen positiven Cashflow generiert, ist CLINUVEL von der australischen Wertpapierbörse nicht verpflichtet, vierteljährliche Bareinnahmen und Aktivitätsberichte auszustellen. Aus Höflichkeit gegenüber den Aktionären werden wir jedoch weiterhin vierteljährlich berichten. Ohne dies wäre die formelle Bekanntgabe der finanzbezogenen Ergebnisse auf den Halbjahres- und den Gesamtjahresabschluss beschränkt.
Hauptversammlung 2021
Das zentrale Ereignis im Investor-Relations-Kalender eines Unternehmens ist ohne Zweifel die Hauptversammlung. CLINUVEL hielt am 10. November seine zweite virtuelle Hauptversammlung ab. Während wir eine persönliche Hauptversammlung vorziehen und hoffen, dass diese im Jahr 2022 wieder aufgenommen werden kann, haben wir aufgrund der Coronavirus-Pandemie im zweiten Jahr in Folge die verfügbare Technologie genutzt, um Aktionäre auf der ganzen Welt zu engagieren. Auf der Versammlung hielten der Vorsitzende und der Geschäftsführer ihre Ansprachen, die Aktionäre stimmten über wichtige Beschlüsse ab und nutzten die Gelegenheit, Fragen zu stellen. Insgesamt äußerte die große Mehrheit der Aktionäre den Wunsch, die Richtung des Unternehmens nicht zu stören.
Nach Rückmeldungen von Aktionären zur Vorstandsvergütung von CLINUVEL auf der Hauptversammlung 2020 haben wir uns ausführlich mit externen Beratern, Stimmrechtsberatern und natürlich Aktionären beraten. Unsere Antwort im Vergütungsbericht 2021 bestand darin, unseren Vergütungsansatz genauer zu erläutern und die Offenlegung der Vergütungsstruktur und der Bedingungen, die für die Gewährung von STI und LTI erreicht werden müssen, zu verbessern. Der Bericht enthielt auch eine aktualisierte Benchmarking-Analyse, die zeigte, dass die Gesamtvergütung des Geschäftsführers unter dem Median einer Gruppe börsennotierter australischer und US-amerikanischer Unternehmen mit vergleichbaren Merkmalen wie CLINUVEL liegt.
Die ausführlichere Erläuterung der Vergütung, die erweiterte Offenlegung und die aktualisierte Benchmarking-Analyse wurden von den beiden führenden unabhängigen Stimmrechtsberatern (CGI Glass Lewis und ISS) anerkannt, indem sie die Abstimmung über die Beschlüsse der Hauptversammlung gemäß den Empfehlungen des Verwaltungsrats unterstützten. Wir freuen uns, dass eine große Mehrheit der Aktionäre diese wichtigen Vergütungsangelegenheiten umfassend bewertet und die führende Position von CLINUVEL in Bezug auf die Gesamtrendite für die Aktionäre anerkannt hat – insbesondere einen Anstieg des CUVAktienkurses um 591% über 5 Jahre mit vier aufeinanderfolgenden jährlichen Dividenden . Als Ergebnis wurden alle Beschlüsse der Versammlung in Übereinstimmung mit den Empfehlungen des Verwaltungsrats unterstützt. Da kein „Streik“ verzeichnet wurde (weniger als 25 % der Aktien stimmten gegen den Vergütungsbericht), musste der bedingte „Spill“-Beschluss nicht berücksichtigt werden. Zwei nicht geschäftsführende Direktoren, Dr. Agersborg und Frau Smith, wurden wiedergewählt, um ihre positive Führung und ihren Überblick über das Unternehmen als wichtige Mitglieder des CLINUVEL-Vorstands fortzusetzen.
CLINUVEL wird von einer Zunahme sowohl der Mitgliederbeteiligung als auch der Anzahl der auf der diesjährigen Hauptversammlung abgegebenen Aktien getragen. Dies ist das Ergebnis einer konzertierten Anstrengung im vergangenen Jahr, um breiter und anders zu kommunizieren, um Beziehungen zu Aktionären auf der ganzen Welt aufzubauen. Dies zeigt sich in häufigeren Investoren-Webinaren, Operations-Update-Webcasts und strategischen Updates, Medieninterviews, regelmäßigen Vorstandsbriefen sowie Nachrichten und wissenschaftlichen Kommuniqués. Wie der Vorsitzende in seinem Brief an die Aktionäre im Geschäftsbericht 2021 erwähnte, „haben wir uns auch bemüht, mit Aktionären in Kontakt zu treten, die ihre Aktien über eine oder mehrere Depotbanken halten; Die Zeit wird zeigen, wie effektiv dieser Prozess war“. So schwierig es auch sein mag, mit Aktionären über mehrere Depotbanken zu kommunizieren, es wurde ein Unterschied gemacht und die Beteiligung der Aktionäre an CLINUVEL ist umso besser. Wir schätzen die Unterstützung aller Aktionäre, insbesondere derjenigen, die auf der diesjährigen Hauptversammlung für die Unterstützung des Unternehmens gestimmt haben, und werden Sie weiterhin positiv und durch die Aufrechterhaltung unserer Führungsrolle bei der Veröffentlichung regelmäßiger Updates über unsere Fortschritte ansprechen.
Traurigerweise haben wir auch den Tod von David Blake miterlebt, einem wahren Führer der Life-Sciences-Investorengemeinschaft im asiatischpazifischen Raum und Mitbegründer von Bioshares. Im Laufe der Jahre haben, durch seine Erkenntnisse, viele von uns profitiert, und wir nutzen diese Gelegenheit, um einen Nachruf von CLINUVEL-CEO Philippe Wolgen zu teilen.
Der letzte Punkt in diesem Kommuniqué von Investor Relations besteht darin, darauf hinzuweisen, dass alle Ankündigungen von CLINUVEL auf den Websites CLINUVEL und CLINUVELNews verfügbar sind. Genauer gesagt sind Mitteilungen an die Australian Securities Exchange auf den Anlegerseiten der CLINUVEL Website verfügbar.
Das DNAReparaturprogramm versucht, die Rolle von Afamelanotid bei der Verjüngung von DNA zu bestätigen… … Während weltweit möglicherweise zwei Milliarden Menschen einen Mangel an DNA-Reparatur Mechanismen aufweisen
Klinische Entwicklungsprogramme
Die laufenden klinischen Programme von CLINUVEL zielen darauf ab, die Sicherheit und den klinischen Nutzen von Melanocortinen für eine Reihe von Patientengruppen, denen es an Alternativen mangelt zu beweisen. Jedes Programm untersucht derzeit sehr unterschiedliche Mechanismen des Potenzials der Melanocortin-Therapie, von denen Patienten mit einer Reihe chronischer und akuter Erkrankungen profitieren können. Vor der Durchführung eines klinischen Programms setzt das Unternehmen klare Ziele, um sicherzustellen, dass die erforderlichen erheblichen Investitionen gerechtfertigt werden können, und alle Risiken werden identifiziert und gemäß den von unserem Team erwarteten Standards gemanagt.
Das DNA-Reparaturprogramm versucht, die Rolle von Afamelanotid bei der Verjüngung von DNA zu bestätigen, die durch Einwirkung von ultraviolettem (UV) und sichtbarem Licht geschädigt wurde. Während weltweit möglicherweise zwei Milliarden Menschen einen Mangel an DNAReparaturmechanismen aufweisen, ist eine Gruppe von Patienten am akutsten betroffen: diejenigen, die mit Xeroderma pigmentosum (XP) leben. Die genaue globale Prävalenz der acht XP-Komplementationsgruppen ist unbekannt, wird aber voraussichtlich von 1 Patient pro 22.000 bis 1 Million Einwohner reichen. Ähnlich wie bei vielen genetischen Störungen gibt es Regionen mit viel höherer Prävalenz, in denen ein bestimmter genetischer Defekt stärker ausgeprägt ist und über Generationen von Familien getragen wurde.
Wir haben zuvor ausführlich die Herausforderungen erörtert, die sich bei der Durchführung eines klinischen Programms mit XP-Patienten stellen, die aufgrund ihrer genetischen Störung eine verkürzte Lebenserwartung haben und von den behandelnden Ärzten sowie den Aufsichts- und Ethikbehörden, zuständig für die Zulassung klinischer Studien, zu Recht geschuetzt werden. Daher war es für unser Team ermutigend, die Genehmigung für den Beginn der ersten Studie mit Fokus auf die Behandlung von XP-C-Patienten (CUV156) zu erhalten. Bei den ersten eingeschlossenen Patienten wurde die Behandlung bis heute gut vertragen und es wurden ueber keine unerwarteten Nebenwirkungen berichtet.
Unser jüngstes Investoren-Webinar befasste sich mit mehreren Fragen zum Vitiligo-Programm und gab einen Überblick über die erzielten Durchbrüche, um unsere nächste Studie, CUV104, voranzutreiben. Vitiligo, eine Depigmentierungsstörung, hat keine zugelassene Therapie, wobei die derzeitigen Standardbehandlungen einen begrenzten klinischen Nutzen bieten und oft viele Monate wiederholte Therapie erfordern, was eine weitere Belastung für Patienten und ihre Familien darstellt. Patienten sind stark stigmatisiert und berichten von einem Identitätsverlust; die sich aufgrund ihrer Erkrankung und der sichtbaren Auswirkungen aus ihrer Gesellschaft und Umgebung zurückziehen muessen oder sich dafür entschieden haben. Der Ansatz von CLINUVEL mit Afamelanotid hat sich seit den ersten Studien weiterentwickelt, wobei eine Zielgruppe – diejenigen mit dunkleren Hauttypen (Fitzpatrick IV-VI), die am besten auf die systemische Therapie als Repigmentierungsmittel ansprechen – klar definiert sind und ein Protokoll für die CUV104-Studie jetzt mit globalen Experten vereinbart wurde. Das Unternehmen wartet nun auf die Genehmigung der USamerikanischen Food and Drug Administration (FDA), um mit CUV104 in den USA beginnen zu können.
Unser jüngstes Investoren-Webinar befasste sich mit mehreren Fragen zum Vitiligo-Programm und gab einen Überblick über die erzielten Durchbrüche, um unsere nächste Studie, CUV104 voranzutreiben.
Fazit
In den kommenden Monaten gehen wir davon aus, weitere Updates zu unseren Programmen veröffentlichen zu können, darunter Neuigkeiten zur neuen Indikation für Afamelanotid und Fortschritte aus unserem VALLAURIX Forschungs-, Entwicklungs- und Innovationszentrum. Wir freuen uns, dies mit Ihnen zu teilen.
Lachlan Hay, Director of Global Operations
1Man muss jedoch anerkennen, dass vieles über EPP noch unklar definiert ist, mit Themen wie Leberfunktionsstörungen und den Auswirkungen der Schwangerschaft auf Phototoxizität, die derzeit noch erforscht werden.
– End –
Autorisiert für ASX-Freigabe durch den Verwaltungsrat von CLINUVEL PHARMACEUTICALS LTD.
Zukunftsgerichtete Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen, die die aktuellen Ansichten und Erwartungen des Managements von CLINUVEL widerspiegeln. Aussagen können eine Reihe bekannter und unbekannter Risiken beinhalten, die dazu führen können, dass unsere zukünftigen Ergebnisse, Leistungen oder Errungenschaften erheblich von denen abweichen, die in solchen zukunftsgerichteten Aussagen ausgedrückt oder impliziert werden. Wichtige Faktoren, die solche Unterschiede verursachen oder dazu beitragen könnten, umfassen Risiken in Bezug auf: unsere Fähigkeit, pharmazeutische Produkte zu entwickeln und zu vermarkten; die COVID-19-Pandemie und/oder andere weltweite, regionale oder nationale Ereignisse, die die Lieferkette über einen längeren Zeitraum betreffen, einschließlich unserer Fähigkeit, biopharmazeutische Produkte zu entwickeln, herzustellen, zu vermarkten und zu verkaufen; Konkurrenz für unsere Produkte, insbesondere SCENESSE® (afamelanotid 16mg), PRÉNUMBRA® oder NEURACTHEL®; unsere Fähigkeit, durch unsere innovativen F&E-Bemühungen die erwarteten Sicherheits- und Wirksamkeitsergebnisse zeitnah zu erzielen; die Wirksamkeit unserer Patente und anderer Schutzmaßnahmen für innovative Produkte, insbesondere angesichts nationaler und regionaler Unterschiede im Patentrecht; unsere potenzielle Gefährdung durch Produkthaftungsansprüche, soweit nicht durch eine Versicherung gedeckt; verstärkte staatliche Kontrolle unserer Vereinbarungen mit Dritten und Lieferanten in Australien, den USA, Europa, Israel, China und Japan; unsere Exposition gegenüber Währungsschwankungen und – beschränkungen sowie Kreditrisiken; die Auswirkungen von Reformen der Gesundheitsregulierung und der Arzneimittelpreise und -erstattung; dass das Unternehmen unerwartete Verzögerungen bei der ausgelagerten Herstellung von SCENESSE®, PRÉNUMBRA® oder NEURACTHEL® erleiden kann, was dazu führen kann, dass es seine kommerziellen Märkte und/oder klinischen Studienprogramme nicht beliefern kann; jegliche Nichteinhaltung von Melde- und Zahlungsverpflichtungen gegenüber staatlichen Zahlungssystemen (d. h. Medicare); Unsicherheiten im Zusammenhang mit den gesetzlichen und regulatorischen Pfaden für die Registrierung und Zulassung von Biotechnologie und verbraucherbasierten Produkten; Entscheidungen von Aufsichtsbehörden über die Zulassung unserer Produkte sowie deren Entscheidungen in Bezug auf Etikettenaussagen; unsere Fähigkeit, Schlüsselpersonal und Führungstalente zu halten oder anzuziehen; die Auswirkungen umfassenderer Veränderungen innerhalb der pharmazeutischen Industrie und verwandter Industrien; potenzielle Änderungen der Steuerverbindlichkeiten oder der Gesetzgebung; Umweltrisiken; und andere Faktoren, die in unserem Geschäftsbericht 2021 erörtert wurden. Zukunftsgerichtete Aussagen beziehen sich nur auf das Datum, an dem sie gemacht werden, und das Unternehmen übernimmt keine Verpflichtung, abgesehen von den nach geltendem Recht oder den einschlägigen Notierungsvorschriften der Australian Securities Exchange vorgeschriebenen, zukunftsgerichteten Aussagen zu aktualisieren oder zu überarbeiten, sei es aufgrund neuer Informationen, zukünftiger Ereignisse oder aus anderen Gründen. Weitere Informationen zu vorläufigen und unsicheren Prognosen und Schätzungen sind auf Anfrage erhältlich, wobei darauf hingewiesen wird, dass die Wertentwicklung der Vergangenheit kein Indikator für die zukünftige Wertentwicklung ist.
Kontakt
Level 11, 535 Bourke St
Melbourne, 3000 Vic,
Australia
+61 3 9660 4900
+61 3 9660 4909