Kommuniqué V, 20-23 September 2020
Liebe Aktionäre, Freunde,
Während die Welt darum kämpft, die Verbreitung von COVID zu kontrollieren, geben wir dem vergangenen Geschäftsquartal und dem Geschäftsjahresende Farbe. Wir ziehen Bilanz und überprüfen den Fortschritt des Unternehmens, um den Kontext bereitzustellen.
Mit Freude haben wir die Zahlen für das letzte Quartal des Geschäftsjahres 2020 (Ende 30. Juni), die unsere internen Prognosen übertroffen haben, erhalten. Wir hatten wenig Zeit, uns mit diesen Ergebnissen zu befassen, da die Prüfung zum Ende des Geschäftsjahres unmittelbar danach fällig war. Diese Prüfung ist eine groß angelegte Übung von intensiven Wochen für alle Mitarbeiter. In dieser Zeit analysieren unabhängige Prüfer alle wichtigen Fragen der Muttergesellschaft und der Tochtergesellschaften. Alle Betriebs- und Finanzberichte werden innerhalb des Konzerns geprüft und alle Governance-Angelegenheiten stehen zur Durchsicht an.
Wie im News Communiqué III wiederholt, testen wir Stresstestprozesse in Bezug auf das Finanzmanagement des Konzerns. Unter der derzeitigen Leitung werden jedes Jahr – ausnahmslos – alle Berichte sauber und ohne materielle Mängel oder wesentliche Beobachtungen veröffentlicht. Ein Finanzvorstand erhält sehr selten Anerkennung für sein Verhalten, aber in Darren Keamy haben wir ein „sicheres Paar Hände, die die Kasse verwalten“. Dieses nahtlose Management bietet dem Verwaltungsrat und den Aktionären von CLINUVEL viel Komfort in einer Welt voller Betrug und außerbilanzieller Aktivitäten. Ich betrachte die Durchführung von Pharmaprojekten auf Geheiß des CFO. Die finanzielle Zweckmäßigkeit ermöglicht eine strategische Planung, die wiederum darauf abzielt, die Geschäftsrisiken in einem Sektor, der bereits mit unkontrollierbaren Risiken Dritter und unvorhergesehenen Verzögerungen behaftet ist, so weit wie möglich zu reduzieren.
Das Geschäftsjahr zum Jahresende 2020 hat eine Umsatzsteigerung von 5% gegenüber dem Vorjahr und eine Erhöhung der Kassenbestände um 23% ergeben. Diese Leistung steht im Einklang mit unserem Ziel, unsere Fähigkeit, das Unternehmen zu vergrößern und den Zeiten des globalen wirtschaftlichen Gegenwinds standzuhalten, voranzutreiben. Angesichts der steigenden Anzahl von Patienten und Behandlungen, des Beginns der Verteilung in den USA und der Entstehung neuer Projekte hätten wir von unserem Team nur sehr wenig in Bezug auf die Leistung verlangen können.Während die Lieferketten im April zum Stillstand gekommen waren, haben die Exportländer Deutschland, Japan und China seitdem ihre Produktionsleistung gesteigert. Die Verlangsamung der Rohstoffe und Fertigprodukte hat CLINUVEL kaum beeinträchtigt, wobei die Europäische Arzneimittel-Agentur die Bereitschaft gezeigt hat, die Prozesse im Zusammenhang mit der Produktfreigabe zu beschleunigen. Ich sehe die Fortschritte von CLINUVEL im Zusammenhang mit der wirtschaftlichen Unsicherheit in der Eurozone, im Vereinigten Königreich und in Australien, die nun alle in eine Rezession geraten sind.Während die Vereinigten Staaten im Quartal ein negatives Wachstum von -8% verzeichneten und seit Februar 11,4 Millionen Arbeitsplätze verloren haben, haben wir in den letzten Wochen eine leichte Erholung der US-Wirtschaft verzeichnet, wobei ungewiss bleibt, ob alle Sektoren im gleichen Tempo folgen werden. Zum Zeitpunkt des Schreibens liegt die Arbeitslosigkeit in den USA zwischen 8,4% und 11,4%, je nachdem, ob man die Personen berücksichtigt, die kürzlich Sozialhilfe beantragt haben. In Europa ist das Bild ebenso düster: Auf die Eurozone entfielen 7,2% der Arbeitslosen mit der Aussicht auf eine düstere wirtschaftliche Erholung, da die COVID-Zahlen stark ansteigen. Wir bleiben auf unbekanntem Gebiet; Hoffnung und Ungewissheit diktieren alle Nationen. Die Möglichkeit eines Impfstoffs bis Mitte 2021 und die Frage, ob rechtzeitig genügend Menschen erreicht werden, wird die Fähigkeit der Regierungen bestimmen, strenge Maßnahmen zu locker.
Insgesamt wird das von den Zentralbanken festgelegte Inflationsziel von 2% (siehe Europäische Zentralbank und Federal Reserve) nicht erreicht. Eine hohe Inflationsrate würde den Zentralbanken und Regierungen theoretisch mehr Spielraum für eine Anpassung der Zinssätze bieten, da in den G8- Ländern die niedrigsten Zinssätze zu beobachten sind. Auf den Märkten gibt es günstige Kredite, und diejenigen Unternehmen, die in der Lage sind, die Kredite längerfristig zu bedienen, sind in einer recht guten Position, um die Krise zu vermeiden. Während die wirtschaftliche Aufregung uns umgibt, sehe ich helle Lichter für CLINUVEL, sofern wir alle bei guter Gesundheit bleiben und uns durch die verschiedenen Projekte arbeiten können, die sich gleichzeitig entwickeln. Die Bewältigung einer Reihe von Krisen hat uns widerstandsfähig gemacht, und wir werden uns diesmal erneut durchsetzen.
CLINUVELS ZIELE
Die FDA-Zulassung im Oktober 2019 hat unseren Teams Raum gegeben, die verschiedenen Forschungsprojekte neu zuzuweisen, mehr Ressourcen für diese Aktivitäten bereitzustellen und Zeit und Arbeitskräfte in die dringendsten Entwicklungen zu investieren. Das vergangene Quartal war insofern wichtig, als wir die Entstehung von PRÉNUMBRA® und den Start des DNAReparaturprogramms gesehen haben. Die Verwendung von Afamelanotid bei UV-induzierten DNA-Schäden stellt einen seriellen Fortschritt in Richtung der Erzeugung endgültiger wissenschaftlicher Beweise dar, die den Nutzen belegen. Der vollständige Kontext und die Bedeutung dieses Programms werden in einem strategischen Update im Oktober erläutert. Im Wesentlichen werden alle Teile zu mehreren Zielen zusammengeführt.
Die Pandemie hat sich sicherlich auf europäische und amerikanische Krankenhäuser und deren Fähigkeit ausgewirkt, neue klinische Studien einzuleiten. Dieser ‚shut down‘ wirkte sich auf die Erforschung von Afamelanotid in unserer nächsten gesponserten Indikation (medizinische Anwendung) aus, die für Juli geplant war. Wir warten jetzt geduldig auf die Entwarnung der zuständigen Behörden vor Ort, bevor wir ein neues Kapitel in einem lebensbedrohlichen Zustand beginnen können.
Insgesamt sind die Unternehmensanreize im gesamten Unternehmen kongruent und bestätigen, dass alle auf die gleichen langfristigen Ziele hinarbeiten. Ich sehe ein Umfeld, in dem sich neu hinzugekommene Talente entwickeln und gedeihen können, und ich habe wenig Zweifel daran, dass unsere funktionsübergreifenden Teams die Ziele erreichen werden, die wir uns im November 2019 gesetzt und verkuendet hatten.
DNA-REPARATURPROGRAMM
Am 14. und 15. September nahmen wir das Polyptychon-Ziel wieder auf, Afamelanotid als regenerative Therapie bei Patienten einzusetzen, die von UV- und sichtbarem Licht betroffen sind.
Nach mehr als einem Jahrzehnt der Arbeit an Studien mit Xeroderma pigmentosum (XP) -Patienten konnten unsere Teams das klinische Programm starten. In XP gibt es einen Ärger von Familien weltweit, therapeutische Mittel zu finden, geschweige denn ein Mittel, um die tägliche Belastung ihrer Kinder zu verringern, die nicht in der Lage sind, sich Licht und Sonne auszusetzen. Für XPPatienten ist Zeit von entscheidender Bedeutung, da diese Gruppe von Krankheiten eine hohe Mortalität aufweist. XP ist auch eine der entstellendsten Krankheiten, auf die man stoßen kann. Endlich in der Lage zu sein, ein systemisches Lichtschutzmittel zu verwenden, ist ein wissenschaftliches Bestreben, das real wird. Die Vorbereitung der Studie CUV150 ist die längste, die ich je gesehen habe, aufgrund der erforderlichen behördlichen und ethischen Zulassungen sowie der erforderlichen Zustimmung von Patienten und ihren Familien.
Im Allgemeinen sind Krankenhäuser und nationale Behörden sehr vorsichtig und zeigen aufgrund der Schwere der Störung und der relativ kurzen Lebenserwartung eine Zurückhaltung, XP-Patienten klinischen Studien zu unterziehen. 2006 hatte ich aus erster Hand von einem US-Unternehmen erfahren, das bei dem Versuch, diese Patienten mit einer topischen Enzymersatztherapie zu behandeln, gescheitert war. Nachdem CLINUVEL den Weg des Unternehmens untersucht hatte, der zur Ablehnung durch die FDA führte, wurde das Ziel fest und eingraviert. Wir waren uns sicher, dass die ersten mit Afamelanotid erzielten Ergebnisse Daten lieferten, die eine Verringerung der Photoprodukte belegen, und von diesem Moment an bestand unsere ultimative Mission darin, ausreichende zusätzliche Beweise zu sammeln, um die Aufsichtsbehörden und Ethikkommissionen davon zu überzeugen, die Behandlung der XP-Population zu bewerten. Die regulatorische Voraussetzung war eine Reihe überzeugender wissenschaftlicher Daten von SCENESSE® (Afamelanotid 16 mg) 1, um die folgenden Argumente vorzubringen:
(i) mittel- und langfristige klinische Sicherheit;
(ii) zweiter Satz sauberer toxikologischer Daten;
(iii) Plausibilität des klinischen Erfolgs bei XP; und
(iv) systemischer Lichtschutz im sichtbaren UVLichtspektrum (HEV).
Im zweiten Quartal 2020 kamen wir zu einer Position, an der alle vier Kriterien erfüllt waren. Wir hatten die Vierjahresgrenze nach der Zulassung überschritten, und die klinische Sicherheit steht nun im Einklang mit über 20 Jahren aufeinanderfolgender Anwendung von Afamelanotid, 16 Jahren bei Patienten mit erythropoetischer Protoporphyrie (EPP) und vier Jahren unter realen Bedingungen – überwiegend im kaukasischen Bereich (fair) ) Hauttypen. Mit dieser unablässigen Aufmerksamkeit für die Sicherheit wurde der XP-Pfad und die letzte Phase des DNAReparaturprogramms eröffnet.
Angesichts des Risikos einer hohen Morbidität (Begleiterkrankungen) und Mortalität sind klinische Studien bei XP-Patienten komplex und müssen eingehend geprüft werden, bevor Entscheidungsträger tatsächlich dem wissenschaftlichen Konzept beitreten können. Im Wesentlichen konzentrierten sich die Gespräche mit den Behörden auf die von Afamelanotid erwarteten Gewinne, die mit der Belastung der Patienten durch die Studie selbst in Einklang gebracht wurden. Zu Recht müssen Entscheidungen über einen langen Zeitraum getroffen werden, um sicherzustellen, dass keiner der Teilnehmer (Behörden, Pharmasponsor, Patienten und Ärzte) einen kritischen Fehler macht. Jeder XP-Patient wird mehrmals gescreent, über die Risiken informiert und vor Beginn der Pilotstudie nachverfolgt. Sobald die Familie und der Patient der SCENESSE®-Therapie zustimmen, verpflichten sich die Fachärzte in einem multidisziplinären Team zur Prüfung und vollständigen Versorgung der Patienten. Der Transport zu und von den Zentren ist sorgfältig geplant, wobei geblendete Fahrzeuge eine Barriere darstellen und das Risiko einer Licht- und UV-Exposition minimieren. Es ist bekannt, dass das Risiko für zusätzliche Lichtschäden und Hautkrebs bei XP 10.000-fach höher ist.
Bei XP haben wir begonnen, einem männlichen XPC-Patienten 16 mg Afamelanotid zu verabreichen, um seine Verträglichkeit gegenüber dem Arzneimittel zu überwachen. Der Patient wird klinisch jeden Tag von medizinischem Personal überwacht, während die Sicherheit und die Wirksamkeit des systemischen Lichtschutzes täglich beurteilt werden. Hautbiopsien liefern histologische (zelluläre) Informationen über den bereits vorhandenen Lichtschaden. Die allgemeinen Ziele bei der Entwicklung von Afamelanotid bei XP-CPatienten lassen sich am besten als Bewertung der folgenden Faktoren zusammenfassen:
(i) Sicherheit bei XP-C-Patienten;
(ii) Auswirkungen auf die Unversehrtheit ihrer Haut (bereits bestehende Poikilodermie);
(iii) Auswirkungen auf Fotoprodukte (nach UVExposition);
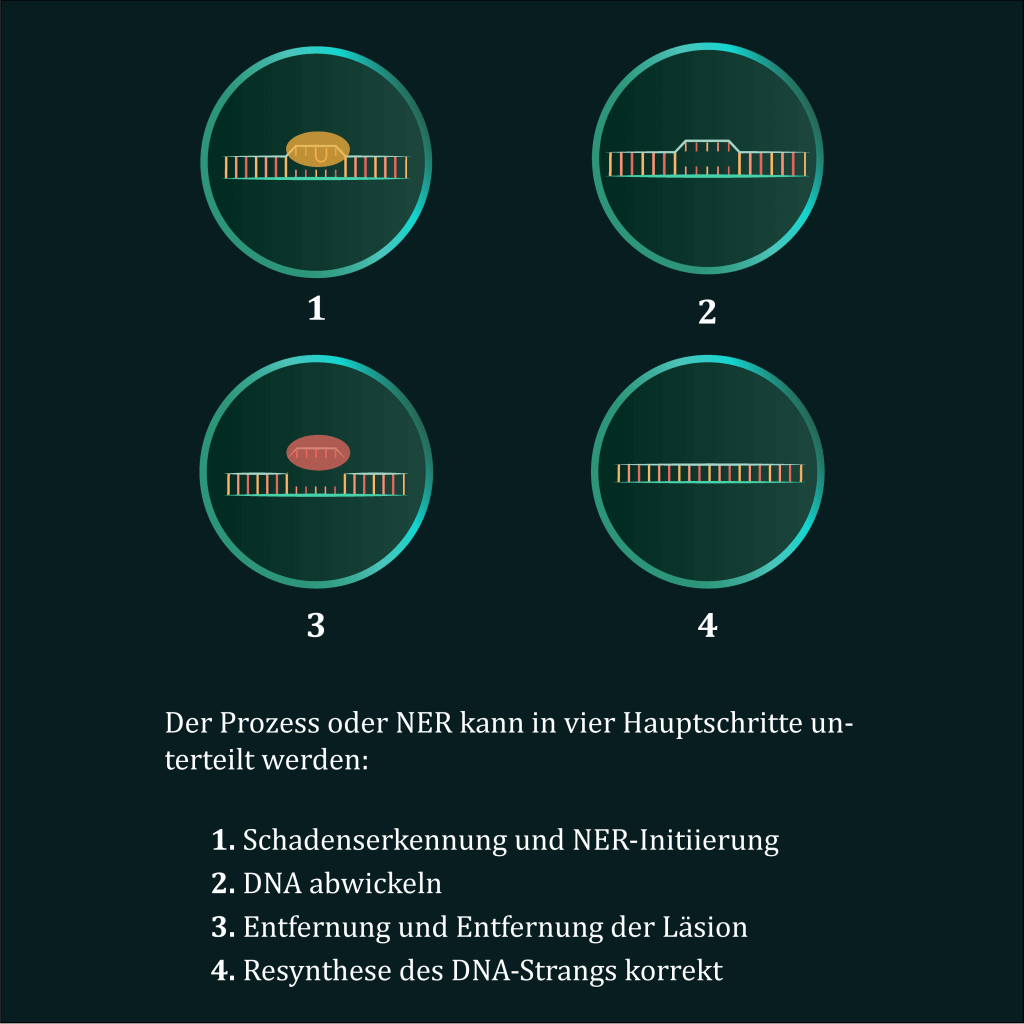
(iv) Auswirkungen auf die NucleotidExzisionsreparatur (NER); und
(v) klinische Wirkungen als systemisches Lichtschutzmittel.
Der NER-Pfad, der nach UV- und HEV-Exposition aktiviert wird, wird in unserem wissenschaftlichen Kommuniqué III ausführlich erläutert und durch ein kürzlich veröffentlichtes Video und mehrere Postings unseres Kommunikationsteams auf SocialMedia-Plattformen unterstützt. In den nächsten Monaten sollen weitere Informationen und Nachrichten zum DNA-Reparaturprogramm und den dazugehörigen Themen veröffentlicht werden.
USA DISTRIBUTION UPDATE
Zum Zeitpunkt der Veröffentlichung von News Communiqué V haben unsere US-Teams Schulungsprogramme und Akkreditierungen für 22 EPP-Spezialzentren in den USA ausgestellt. Unser Ziel im April war es, bis zum vierten Quartal 2020 10 akkreditierte Zentren und bis zu 30 Zentren zu erreichen, die in Phase 2 des US-Vertriebsplans (Juni 2021) geschult wurden. Erfreulicherweise liegen Dr. Teng und ihre Mitarbeiter dem Zeitplan voraus, und das Team ist bestrebt, eine breite geografische Verteilung der aktiven Zentren in den USA sicherzustellen, um Patienten aufzunehmen. Die Gemeinsamkeit unseres US-Ansatzes ist „das Medikament in der Nähe der Cluster von USPatienten“
Auf den ersten Blick entspricht das erste klinische Ansprechen der Patienten auf SCENESSE® den Erwartungen, und die Sicherheitsdaten ähneln denen, die im Laufe der Jahre in Europa beobachtet wurden. Insofern haben wir keine neuen und unerwarteten Informationen zur Pharmakovigilanz (medizinische Überwachung von Nebenwirkungen) erhalten. In diesem Monat werden wir der FDA einen Jahresbericht vorlegen, der die neuesten Sicherheitsergebnisse zusammenfasst. Der nächste Bericht über regelmäßige unerwünschte Arzneimittelerfahrungen wird im November veröffentlicht
Zwischenzeitlich werden weiterhin Vereinbarungen mit US-amerikanischen Versicherern über die Behandlung im Rahmen der vorherigen Genehmigung (PA) getroffen. Einige Versicherer greifen jedoch auf einen langwierigen Austausch mit Ärzten zurück, um die für die Implantation von SCENESSE® erforderliche klinische Beratung zu erstatten. Wir stellen fest, dass diese Diskussionen im Allgemeinen zu einem zufriedenstellenden Ergebnis für die Gesundheitsdienstleister und klinischen Mitarbeiter führen, wenn sie ihre Konsultationszeit erstatten. Der Prozess von PAs kann für die erste Behandlung zeitaufwändig sein, während zweite und nachfolgende Behandlungsanfragen schneller und ohne Abfragen bearbeitet werden. Jeder EPP-Patient hat Zugang zu unserem US-Team, um weitere persönliche Unterstützung während des Erstattungsprozesses zu erhalten, da Versicherer häufig weitere Produktinformationen anfordern.
Verschiedene medizinische Einrichtungen arbeiten nach ihren eigenen Formeln, und zwei größere Krankenhäuser haben kürzlich SCENESSE® in ihre „interne Formel“ aufgenommen. Dies ist ein bedeutender Schritt im ganzen Land, um das Medikament als Standard für die Behandlung in der EPP anzuerkennen. Die aktuellen Formulare dienen als zukünftige Referenz für andere Institute, die eine Bestätigung der einheitlichen Preisgestaltung anstreben.

SCENESSE® wird als Spezialarzneimittel bezeichnet und als verschreibungspflichtige Tier 4-Therapie aufgeführt, die in einem medizinischen Umfeld (d. H. In einer Arztpraxis oder einer ambulanten Krankenhauseinrichtung) verabreicht wird. Abhängig vom abgeschlossenen Versicherungsplan können Krankenversicherungen eine Zuzahlung von den versicherten EPP-Patienten erfordern. Es gibt jedoch ein jährliches Auslagenmaximum von bis zu 8.150 US-Dollar für medizinische Behandlungen, die im Rahmen einer medizinischen Leistung erhalten werden. Unsere Teams arbeiten weiter daran, eine gerechte Behandlung von US-amerikanischen EPP Patienten sicherzustellen.
VALLAURIX-ERWEITERUNG
Mit viel Stolz haben wir am 31 August unser singapurisches Forschungs- und Entwicklungszentrum (VALLAURIX) eröffnet. Während wir unsere Ausgaben für Forschung und Entwicklung erhöhen, ziehen bestimmte Projekte jetzt neue Talente in Singapur an. VALLAURIX ist eines der wenigen Forschungsunternehmen in der Region, das neue Mitarbeiter rekrutiert.
Neue wissenschaftliche Mitarbeiter werden in den Bereichen Peptidchemie und Polymerwissenschaft, fortgeschrittene analytische Chemie und regulatorische Chemie-Fertigungs-Kontrolle (CMC) eingestellt. Während die globale Qualitätskontrolle weiterhin von Europa aus koordiniert wird, sind lokale QC-Mitarbeiter vor Ort. Zur Stärkung der Teams wurden spezielle Fachleute für Regulierungsangelegenheiten hinzugefügt. In Bezug auf die Ausstattung erweitern wir unsere Einrichtungen vor den Anforderungen, damit die Labors alle Funktionen intern erfüllen können. In enger Zusammenarbeit mit dem Singapore Economic Development Board sichern wir uns die Subventionen für die Rekrutierung lokaler Talente und Investitionen.

Die Arbeiten an den Molekülen CUV9900, Phimelanotid und Parvysmelanotid treten in eine neue Phase ein, während weitere Analysemethoden entwickelt werden. Wie im Juli angekündigt, führen wir mit PRÉNUMBRA® eine flüssige Formulierung von Afamelanotid im eigenen Haus ein, um die Dosierungsflexibilität des Hormonanalogons Afamelanotid bei akuten und systemischen Erkrankungen zu ermöglichen. Das Produkt der zweiten Generation baut auf wissenschaftlichen Erkenntnissen über die pharmakodynamischen Wirkungen von Afamelanotid auf und nutzt vorhandene Technologien. Wie gesagt, besteht das Ziel darin, eine injizierbare flüssige Dosierungsform in einem polymeren Träger zu kommerzialisieren, wodurch eine modifizierte Freisetzung von Afamelanotid bereitgestellt wird. Die Entwicklung der neuen Formulierung orientiert sich am Quality by Design-Ansatz.
ÖFFENTLICHKEITSARBEIT UND INVESTORENBEZIEHUNGEN
Seit Januar 2020 wurden wichtige Ereignisse in unserem Kalender in virtuelle Besprechungen umgewandelt. Die Intensität der Kommunikation mit der Finanzgemeinschaft in Australien und den USA hat sich jedoch nicht verringert, wie aus unseren internen Protokollen hervorgeht. Ein Teil der Überwachung unserer internen Ausgabe bestand darin, eingehende E-Mails, Anrufe und Videokonferenzen seit dem 1. März aufzuzeichnen. Nach sechs Monaten stellen wir eine Produktivitätssteigerung fest, die sich aus der Häufigkeit der Kommunikation und dem Fortschritt der Projekte ergibt. In einer Welt, die dazu verdammt ist, von zu Hause aus zu arbeiten, erholt sich unser Büropersonal von einer Notlage, die viele noch nie zuvor erlebt hatten.
Die positiven Finanzergebnisse des Unternehmens wurden gut aufgenommen, da diese während der Pandemie erzielt wurden. Wir haben den Anstieg der Ausgaben bewusst kontrolliert, um das Wachstum und die Expansion des Konzerns zu unterstützen. Der Kommentar spiegelt das Verständnis unserer langjährigen Strategie wider, die über die Jahre hinweg konsequent kommuniziert wurde.
Positive Rückmeldungen gingen auch von verschiedenen Aktionären zur Erklärung der dritten jährlichen Dividende in Folge ein. Die nicht frankierte Dividende von 0,025 AUD pro Aktie für das Geschäftsjahr 2020 stimmte mit der Dividende für das Geschäftsjahr 2019 überein, was einer Steigerung von 25% gegenüber der ersten Dividende von 0,02 AUD pro Aktie im Jahr 2018 entspricht. Zu einer Zeit, in der viele Unternehmen keine Erklärung abgeben können Nachdem der Verwaltungsrat eine Dividende ausgeschüttet hatte oder seine Ausschüttungsquote reduzieren musste, um Barreserven zur Finanzierung des laufenden Geschäftsbetriebs bereitzustellen, zeigte er weiterhin seine Wertschätzung für die langfristige Unterstützung der Aktionäre und die Notwendigkeit, in diesen unsicheren Zeiten gesunde Barreserven aufrechtzuerhalten. Dieser Ansatz wurde in den bisher erhaltenen Rückmeldungen der Aktionäre berücksichtigt. Die endgültige Dividende je Aktie zum Stichtag 04. September 2020 belief sich auf 1,235 Mio. AUD und wurde am 18. September 2020 ausgezahlt. Dies ist eine positive Steigerung der Gesamtrendite für die Anleger von CLINUVEL.
Das Unternehmen hat in den letzten Monaten Ankündigungen zur finanziellen und operativen Leistung und zum Fortschritt der Forschungs- und Entwicklungsprogramme veröffentlicht. Der jüngste operative Nachrichtenfluss spiegelt den Anstieg der F & E-Investitionen wider, einschließlich der Ankündigung von PRÉNUMBRA®, der Eröffnung des Forschungs- und Entwicklungszentrums in Singapur und in diesem Monat des DNA-Reparaturprogramms. Wir haben Unterstützung aus vielen Quellen für unsere Initiative zur Unterstützung der XP-Patientenpopulation erhalten.
Alle Ankündigungen des Unternehmens sind auf der CLINUVEL-Website unter www.clinuvel.com verfügbar. Die wichtigsten Ankündigungen für 2020 sind in der nachstehenden Tabelle aufgeführt.
|
Wichtige Ankündigungen an die australische Wertpapierbörse – 2020, seit Jahresbeginn |
||
|
Datum |
Ankündigung |
Details |
|
16 Januar |
CLINUVEL Newsletter |
Communique I – 2020 |
|
31 Januar |
Anhang 4C – vierteljährliche |
Geldeingänge, Dezemberquartal 2019 |
|
03 Februar |
Die australische TGA beginnt mit dem SCENESSE®-Überprüfungsdossier |
Das unter dem Prioritätsregistrierungspfad geprüft werden soll |
|
10 Februar |
Antrag auf FDA-Beratungstreffen SCENESSE® in Vitiligo |
Antrag auf Typ-C-Beratungstreffen |
|
24 Februar
|
CLINUVEL erweitert Erweiterung des Singapore Laboratories |
Laboratory mit Zuschüssen der Regierung von Singapur |
|
26 Februar |
Anhang 4D Halbjahresergebnisse |
Finanzbericht , Halbjahr bis Dezember 2019 |
|
27 Februar |
Unternehmenspräsentation Halbjahresergebnisse |
Fokus auf Dezember 2019, Halbjahresergebnisse |
|
02 März |
Lieferung von SCENESSE®, das nicht von Coronavirus betroffen ist |
SCENESSE® und seine Hilfsstoffe, die nicht von Coronavirus betroffen sind |
|
03 März |
FDA-Sitzung bestätigt, um SCENESSE® in Vitiligo |
Typ C Guidance Meeting voranzutreiben, bestätigt für 29. April |
|
12 März |
Brief des Vorsitzenden an die Aktionäre |
Brief des Vorsitzenden I – 2020 |
|
19 März |
CLINUVEL Newsletter |
Communique II – 2020 |
|
23 März |
US Distribution Update |
Unternehmenspräsentation zur US Distribution SCENESSE® |
|
23 März |
CLINUVEL startet SCENESSE® im April in den USA |
Einführung einer schrittweisen Einführung der US-Behandlung geplant |
|
16 April |
Erste US-Patienten Behandlung mit SCENESSE® |
US Markteinfuehrung von CLINUVEL’s innovativem Medikament SCENESSE® |
|
23 April |
CLINUVEL startet SCENESSE® Supply in China |
Vereinbarung mit Winhealth Pharma zum Start des Pilotprogramms |
|
28 April |
Anhang 4C – vierteljährliche |
Geldeingänge, März-Quartal 2020 |
|
01 Mai |
FDA-Typ-C-Treffen für SCENESSE® in Vitiligo |
Typ-C-Leitfaden mit der FDA |
|
08 Mai |
Brief des Vorsitzenden an die Aktionäre |
Brief II – 2020 des Vorsitzenden |
|
19 Mai |
CLINUVEL Newsletter |
Communique III – 2020 |
|
20 Mai |
Präsentation am UBS Global Healthcare Conference |
Präsentation des Unternehmensupdates zur virtuellen Konferenz |
|
05 Juni |
Präsentation Jefferies Global Healthcare Conference |
Präsentation des Unternehmensupdates zur virtuellen Konferenz |
|
13 Juli |
PRÉNUMBRA® – Neue Präsentation von flüssigem Afamelanotid
|
Zweite Formulierung von Afamelanotid
|
|
22 Juli |
CLINUVEL Newsletter |
Communique IV – 2020 |
|
31. Juli |
Anhang 4C – vierteljährliche |
Geldeingänge, Juni-Quartal 2020 |
|
31. Juli |
Corporate Update |
Präsentation des Corporate Updates |
|
27. August |
Anhang 4E und vorläufiger Abschlussbericht |
Für das am 30. Juni 2020 endende Geschäftsjahr |
|
27. August |
CLINUVEL Gesamtjahresergebnisse |
Viertes Jahresergebnis in Folge |
|
27. August |
Erklärung der Dividende für das Gesamtjahr |
Dritte jährliche Dividende in Folge |
|
27. August |
Unternehmenspräsentation |
Konzentrieren Sie sich auf die Ergebnisse des Gesamtjahres 2020 |
|
31. August |
Eröffnung des VALLAURIX-Forschungs- und Entwicklungslabors in Singapur |
Neue Forschungs- und Entwicklungseinrichtung in Singapur eröffnet |
|
10. September |
SCENESSE® in DNA Repair |
CLINUVEL entwickelt innovatives DNA-Reparaturprogramm weiter |
|
15. September |
Erster Patient, der im SCENESSE®-DNA-Reparaturprogramm behandelt wurde |
Xeroderma pigmentosum (XP) -Patient wird behandelt |
|
23. September |
CLINUVEL bestätigt das Datum der Hauptversammlung |
das für den 11. November 2020 um 18.00 Uhr AEDT festgelegt wurde |
|
23. September |
CLINUVEL Newsletter |
Kommunique V – 2020 |
Wir informieren potenzielle Aktionäre häufig über CLINUVEL und erläutern die Natur des innovativen biopharmazeutischen Unternehmens mit seiner langfristigen strategischen Ausrichtung, seinem stabilen und erfahrenen Management und haben eine Erfolgsbilanz für positiven Cashflow und Rentabilität aufgestellt. Wir sorgen für eine gemessene Verteilung der Renditen an die Aktionäre und verfügen über gesunde Barreserven, um das Wachstum des Geschäftsbetriebs und die Ausweitung der Aktivitäten zur Behandlung mehrerer Patientengruppen selbst zu finanzieren. Wir ziehen weiterhin das Interesse privater und institutioneller Investoren an. Viele der interessierten institutionellen Anleger haben einen langfristigen Anlagehorizont, der zum gewählten Geschäftsmodell passt und Stabilität bietet, um sich auf unsere Kernziele zu konzentrieren. Dieses Interesse wird durch die unabhängige Berichterstattung über CLINUVEL (auf der CLINUVEL-Website aufgeführt) sowie durch das Personal von Kunden von Investmentbanken und Brokern, die regelmäßig über die Fortschritte des Unternehmens informiert werden, gestützt. Wir haben im Jahr 2020 neue institutionelle Anleger aufgenommen und können allgemeiner berichten, dass die Zahl der eingetragenen Aktionäre im Laufe des Jahres bis zum 15. September 2020 um 36% auf 5.449 gestiegen ist. Der Kalender der geplanten Veranstaltungen wird aktualisiert, wobei die Häufigkeit von Verschiebungen und Stornierungen festgestellt wird Ereignisse aufgrund der Coronavirus-Pandemie und unserer Teilnahme an virtuellen Konferenzen.

Wir haben uns weiterhin darauf konzentriert, an diesen Konferenzen teilzunehmen, um ein größeres Publikum potenzieller Investoren zu erreichen und die CLINUVEL-Geschichte und die zwingenden Gründe zu erzählen, uns als Investition zu betrachten. Die Konferenzpräsentationen, die wir der ASX ankündigen, dienen auch dazu, die Geschichte auf den neuesten Stand zu bringen und bestehende und potenzielle Investoren über den Fortschritt zu informieren.
Einige neue Konferenzen wurden zu den geplanten Veranstaltungen hinzugefügt, vorbehaltlich der endgültigen Bestätigung.In den kommenden Wochen werden wir ein strategisches Update bereitstellen, den Geschäftsbericht 2020 fertigstellen und verteilen sowie die virtuelle Hauptversammlung am Mittwoch, den 11. November 2020, um 18.00 Uhr AEDT vorbereiten. Generell werden wir weiterhin alle Beteiligten über den Fortschritt des Forschungs- und Entwicklungsprogramms auf dem Laufenden halten.
ZUSAMMENFASSUNG
Wie viele Life-Science-Akteure stehen wir in der heutigen Zeit vor einer enormen Herausforderung, und unsere Unternehmensgruppe stellt sich bislang dieser Aufgabe. Operations, F & E und Finanzen sind in den meiner Meinung nach prüfendsten Monaten des Bestehens von CLINUVEL positiv aufeinander abgestimmt. Wir haben uns zum Ziel gesetzt, ein Unternehmen für viele Jahre zu gründen, zu wachsen und den Mitarbeitern Arbeitsplatzsicherheit zu bieten, während Millionen von Menschen ihre Einkommensquelle verlieren. Ich möchte, dass CLINUVEL sich von seinen Mitbewerbern abhebt und sich wirklich um seine Mitarbeiter kümmert. Dies ist ein sicheres Umfeld für Fachleute, die ihre individuellen Talente entwickeln möchten, wenn auch unter Zeitdruck, um gemeinsam Ergebnisse zu erzielen. Es muss ein Ort sein, an dem Fachleute an einer Reihe von Anreizen arbeiten, die auf unsere Unternehmensziele abgestimmt sind.
In den letzten acht Wochen haben wir viele Fortschritte erzielt, wie die Tabelle der wichtigsten Ankündigungen (oben) zeigt. Wert wird aufgebaut und das Unternehmen wird von einem wachsenden Pool von Finanzinstituten und -dienstleistungen wahrgenommen. CLINUVEL hat sein Vermögen im vergangenen Jahr um 29% erhöht und überwacht seine Ausgaben weiterhin sorgfältig, um einen schlanken Betrieb aufrechtzuerhalten.
Die kommenden Monate sind ebenso spannend, da wir mehr Daten über neue Produkte in der Entwicklung sammeln, uns über die Fortschritte bei XP informieren und auf die Genehmigung neuer Programme für Afamelanotid warten.
Ich danke Ihnen allen für Ihre fortgesetzte Unterstützung und die gemeinsame Begeisterung für das Unternehmen.
Philippe Wolgen
1SCENESSE® (afamelanotide 16mg) ist in der Europäischen Union als Arzneimittel für seltene Leiden zur Vorbeugung von Phototoxizität bei erwachsenen Patienten mit zugelassen EVP. SCENESSE® ist in den USA zugelassen, um die schmerzfreie Lichtexposition bei erwachsenen EPPPatienten mit einer Vorgeschichte von Phototoxizität zu erhöhen. Informationen zum Produkt finden Sie auf der Website von CLINUVEL unter www.clinuvel.com.
Download Pdf